بحث عن التوزيع الالكتروني وما هي القواعد التي تحكم
طريقة البحث عن التوزيع الالكتروني علم الكيمياء يركز على فهم طبيعة المادة وتحليل مكوناتها، بالإضافة إلى دراسة التفاعلات الكيميائية بينها. يهتم أيضًا بدراسة خصائص المواد وتغيراتها، ويتضمن فروع متنوعة مثل الكيمياء التحليلية، والعضوية، واللاعضوية، والحيوية، والفيزيائية. في هذا السياق، يركز البحث على موضوع التوزيع الإلكتروني وأثره على خصائص المواد وتفاعلاتها الكيميائية
جدول المحتويات
كيفية البحث عن التوزيع الالكتروني
التوزيع الإلكتروني يعد موضوعا أساسيا في علم الكيمياء، حيث يتم دراسته ووضع القوانين التي تحدده، وقبل التعمق في دراسته يتعين فهم مفهوم الإلكترون ودوره كجزء من تكوين الذرة وحركته حولها
- يمكن تجاهل كتلة الإلكترون نظرًا لصغرها المطلق، لكن لا يمكن تجاهل شحنتها نظرًا لتأثيرها على الذرة
- وتعتبر كتلة الإلكترونات غير مهمة نسبياً نظرًا لتركيز كتلة الذرة في النواة، التي تحتوي على البروتونات المشحونة إيجابيا والنيوترونات المتحيزة نحو الحياد
- وعندما يتساوى عدد الإلكترونات السالبة مع عدد البروتونات الموجبة في النواة، تصبح الذرة كهربيا متعادلة في حالتها الأساسية
- ويعرف العدد الذري بكونه عدد البروتونات في النواة، بينما العدد الكتلي يشمل عدد البروتونات والنيوترونات
خطوات التوزيع الصحيح للالكترونيات
يتم توزيع الإلكترونات في الذرة بطريقة متتابعة عبر عدة خطوات
- حيث يجب أولاً أن يتساوى عدد الإلكترونات مع العدد الذري للذرة
- يتم بدء التوزيع من المدارات ذات الطاقة الأدنى في الذرة
- ولا يجوز وجود أكثر من اثنين من الإلكترونات في المدار نفسه
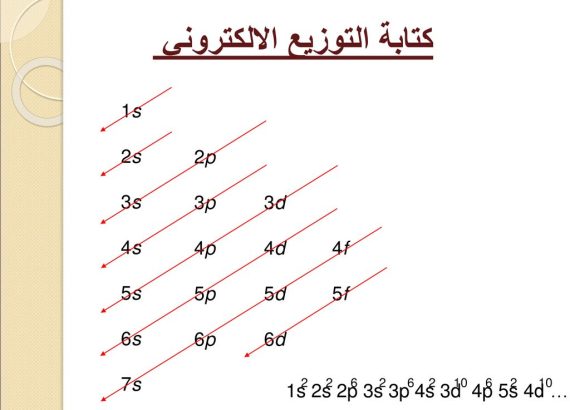
كيف يحدث التوزيع الالكتروني
تتوزع الإلكترونات في مدارات الذرة وفقًا للقاعدة العامة 2n^2، حيث يمثل “n” رقم مستوى الطاقة
- يستوعب المدار الأول ما يصل إلى 2 إلكترون
- بينما يمكن أن يحتوي المدار الثاني على حد أقصى يصل إلى 8 إلكترونات، والمدار الثالث يمكن أن يحتوي على حد أقصى يصل إلى 18 إلكترونيا
- ويشترط أن لا يتجاوز عدد الإلكترونات في المدار الأخير 8، بغض النظر عن رقم المدار
- كما يتساوى العدد الذري مع عدد البروتونات في النواة، وعادة ما يكون عدد الإلكترونات متساويا لعدد البروتونات في الذرة المتعادلة
اقرأ أيضًا: للاختبار الكمي ورقي ومحوسب | أين يباع كتاب المعاصر 8 لاختبارات القدرات وكم يبلغ سعره؟!
القواعد التي تحكم التوزيع الالكتروني
هناك عدة قواعد تحكم في توزيع الإلكترونات في الذرة، منها قاعدة أوف باو وقاعدة هوند وقاعدة الاستبعاد لباولي
- قاعدة أوف باو، تتبنى هذه القاعدة مبدأ البناء التصاعدي، حيث تدخل الإلكترونات في المستويات الفرعية ذات الطاقة الأقل أولاً قبل الانتقال إلى المستويات ذات الطاقة الأعلى
- وتشغل الإلكترونات المدار 1s قبل 2s في الذرة، ويرمز لطاقة المدار باستخدام الرمز “n”
- وعند التشابه بين أعداد الكمية n وℓ وmℓ، يجب أن يكون العدد الكمي الرابع ms مختلفا عنهم
- قاعدة هوند تحدد هذه القاعدة أن عدد الإلكترونات الموجودة في المدار يجب أن يكون منفرداً إذا لم يكن عددها أكبر من عدد المدارات
اقرأ أيضًا: اسئله قدرات لفظى بأنواع مختلفة
لماذا التوزيع الالكتروني؟
توزيع الإلكترونات في الذرة يتبع ثلاث حقائق أساسية
- في الفضاء الضيق داخل الذرة، تكون طاقة الإلكترونات وخواصها الأخرى محصورة في حالات كمية محددة، وتعرف هذه الحالات بالمدارات الإلكترونية، حيث تختلف طاقة كل مدار
- الإلكترونات تتبع مبدأ استبعاد باولي نظرًا لأنها فرميونات، وينص هذا المبدأ على أنه لا يمكن لاثنين من الإلكترونات أن تشغل نفس الحالة
- وعندما يشغل إلكترون حالة معينة، يجب على الإلكترون التالي أن يشغل حالة مختلفة
- يحتوي أي نظام على توزيع إلكتروني واحد فقط، وفي حالة الاتزان يعرف التوزيع باسم “الحالة الأرضية”
- وإذا لم تكن الحالة الأرضية متاحة، فإن أحد الإلكترونات سيكون تحت تأثير التسخين أو التفريغ الكهربي
على هذا نكون قد قدمنا بحثا عن التوزيع الالكتروني وكيفيه عمله وما هي القواعد التي تحكمه بالاضافه الى الخطوات المتبعه اثناء التوزيع الالكتروني



